|
Félix Espoz. Madrid
La Agencia Española de Medicamentos (Aemps) ha presentado su memoria anual, en la que destacan un incremento del 19 por ciento en la autorización de fármacos, sus actuaciones en lo referente a medicamentos ilegales y falsificados y su apuesta por la administración electrónica y la mejora de los plazos, puntos en los que el sector le reconoce avances, si bien identifican áreas de mejora.
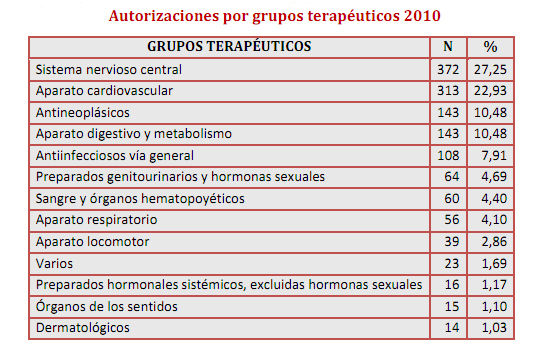
En 2010 la Aemps autorizó la comercialización de 1.393 medicamentos, lo que supuso un 19 por ciento más que en 2009. De todos ellos, el 72 por ciento fueron medicamentos genéricos. A estas cifras hay que sumar las más de 21.000 solicitudes de variaciones de medicamentos ya autorizados.
En el ámbito de los productos sanitarios, la Aemps otorgó el marcado CE de conformidad europeo a 192 productos y prorrogó los certificados CE a otros 1.101 productos. Asimismo, llevó a cabo 104 auditorías de calidad a los fabricantes.
La Agencia ha destacado su “liderazgo” en materia de administración electrónica, “ya que en la actualidad dispone de un total de 66 procedimientos electrónicos mediante los cuales en 2010 se resolvieron más de 60.000 trámites por vía telemática”.
Reacciones de las patronales
Emili Esteve, director del Departamento Técnico de Farmaindustria, asegura que las relaciones con la Agencia son “excelentes” y destaca que en la mejora de los plazos “aún queda camino por recorrer”.
“Pensamos que uno de los aspectos que están mejorando y que necesitan una cierta atención es la mejor coordinación con la Dirección General de Farmacia. El paso siguiente a la aprobación de un medicamento es ver si se financia o no, y creemos que esto debería darse de forma continua e instantánea”, explica, y sugiere “más coordinación”.
“Creo que vamos a conseguir avanzar en este sentido gracias a la implementación de la administración electrónica. La supresión de las autorizaciones en papel va a suponer un antes y un después en el funcionamiento de la agencia. Creo que va a ser un punto de inflexión”, añade Esteve. “La agencia está poniendo los mimbres para mejorar sustancialmente los trámites. Es una buena noticia”, afirma.
Por su parte, el director general de Aeseg, Ángel Luis Rodríguez de la Cuerda, destaca el volumen que representan los genéricos para la Agencia, “lo que da cuenta de la importante inversión que implica para los laboratorios en solicitudes de registro” y los ahorros para el sistema que supone.
Señala que vienen trabajando conjuntamente con la agencia en lo referente a los plazos, “con el objetivo de acelerar los procedimientos de registro. En España, de media un genérico tarda 18 meses en obtener la autorización de comercialización, mientras que en la Comunidad Europea ese plazo es de 10 meses”.
Falsificación de medicamentos y apoyo a la investigación
En el caso de medicamentos ilegales y falsificados, cabe destacar que en 2010 se registró una tendencia al alza en este tipo de intervenciones. Destaca el importante incremento en el número de muestras remitidas a los laboratorios de la Agencia por parte de los juzgados y Cuerpos y Fuerzas de Seguridad del Estado, que en 2010 llegó a la cifra de 2.041 (casi mil más que en 2009). En el caso de investigaciones de páginas web que vendían de forma ilegal medicamentos por Internet, se realizaron 88 actuaciones (7 más que en 2009).
El informe de la Aemps señala que autorizó el año pasado 643 ensayos clínicos y 133 productos en fase de investigación con medicamentos de uso humano.
Sobre este respecto, Esteve identifica como punto de mejora los plazos en las fases iniciales: “No porque no los cumpla, sino porque las alegaciones nos las mandan al final del procedimiento. Nos gustaría recibir las objeciones al inicio de la tramitación. Si las envían al final, más en ensayos que son competitivos con otros países, aquí aún no se ha finalizado el ensayo y otros países te llevan la delantera”.
El papel de la Agencia
Por último, Esteve recalca que esperan “que la Agencia crezca y se fortalezca”, ya que para la industria “es fundamental que la Agencia sea un buen interlocutor (es más fácil entenderse), un buen embajador (se puede vehiculizar a través suyo los procedimientos de reconocimiento mutuo) y un buen colaborador (ya que sus disposiciones afectan a la industria)”.
Según Rodríguez de la Cuerda, desde Aeseg se entiende que “sería bueno que la Agencia tuviera un rango de agencia autónoma para poder administrar los recursos que ingresan y poder obtener los objetivos marcados”. |