|
Redacción. Madrid
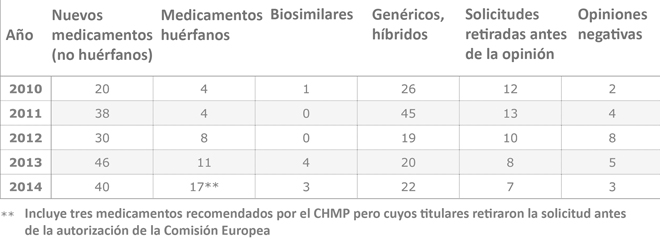
La Agencia Europea del Medicamento (EMA) dio en 2014 el visto bueno a 82 nuevos medicamentos, la mayor cifra de aprobaciones en el último lustro. Casi una cuarta parte, 17 fármacos, están indicados para el tratamiento de enfermedades raras (aquellas cuya prevalencia es menor de 5 personas por cada 10.000 habitantes en el continente), un nuevo récord en el número de positivos anuales, lo que marca una clara tendencia de la investigación farmacéutica hacia este tipo de patologías.
Medicamentos aprobados en el último lustro. Fuente: EMA.
|
Ya 2013 había superado el listón anterior al ver la luz 11 nuevos medicamentos huérfanos, 3 más que en 2012, año que marcó otro récord. La orientación de la investigación farmacéutica hacia nichos no explorados y los incentivos otorgados a los laboratorios que desarrollan este tipo de fármacos (desde exención de tasas hasta procedimientos acelerados de aprobación) han jugado un papel fundamental en este crecimiento tan significativo: en la década pasada, los nuevos fármacos para enfermedades poco frecuentes aparecían con cuentagotas.
Entre las patologías que encuentran por fin una opción de tratamiento están la distrofia muscular de Duchenne, la protoporfiria eritropoyética o la deficiencia de células madre limbares. Para esta última se ha aprobado la primera terapia basada en células madre en Europa.
Gran año en nuevos medicamentos
No solo el abanico de fármacos para enfermedades raras ha vivido una gran progresión en los últimos doce meses. Las aprobaciones de nuevos medicamentos, huérfanos excluidos, ha alcanzado la segunda mejor cifra de los últimos cinco años, con 40 positivos, solo 6 menos que la ‘cosecha’ de 2013.
Oncología fue una de las áreas terapéuticas más beneficiadas, con 8 nuevos medicamentos, algunos de ellos para cánceres poco comunes. La hepatitis C también vivió un gran momento, con cuatro novedades, que además fueron aprobadas tras haber obtenido una evaluación acelerada por parte de las autoridades. Las altas tasas de curación y la capacidad de cambiar la forma en que los pacientes de esta enfermedad son tratados jugaron un papel crucial para que la EMA concediera a los fármacos este tipo de evaluaciones.
También ha sido un año bueno para los biosimilares, con tres aprobaciones, una menos que en 2013, si bien en los tres años anteriores solo se había aprobado un producto más de estas características.
El ritmo de aprobaciones de genéricos se mantiene con respecto a los últimos ejercicios, alrededor de la veintena de positivos. Son cifras, sin embargo, alejadas de los picos que se produjeron la última década, cuando podían alcanzarse el medio centenar de nuevos EFG. Hay que tener en cuenta, sin embargo, que estos pueden ser aprobados por la vía descentralizada, es decir, país por país, y por tanto esta cifra no es tan significativa como en el resto de casos.
|


